
水滴が金属表面に付着すると, 全面腐食が始まることがあります. 場合によっては, 十分な接触時間があれば, この腐食によって金属表面に非常に小さなピットが形成されます. このようなピット内の状態は, 時間の経過とともに, ピットの底が正味の陽極分極面となり, ピットの口から離れた領域が正味の陰極面として機能するようになります. これによりピット底部の腐食が加速され, 大きなピットが形成されます. 孔食のモデル化は, 特定の材料や設計が特定の条件下でどのように孔食の影響を受けやすいかを理解するにおいて役立ちます. このブログでは, 孔食を研究するためのモデルがどのようなものかを解説します.
腐食プロセスとは何か
ガルバニック腐食は, 電子に対する親和性が異なる2つの金属の電子的, イオン的接触によって引き起こされます. このような2つの金属を同じ電解質と接触させると, 電解質に対してその表面に電気二重層を形成します. この電気二重層にかかる電圧は, 2つの金属で異なります. その結果, 図1に示すように, 電子は卑金属から貴金属へと伝導されます.
貴金属表面では, これらの電子は電荷移動反応に寄与する可能性があり, 貴金属では正味の還元反応 (陰極反応) となります. 卑金属では, 電子が取り込まれ, この電荷移動反応により, 正味の陽極反応で卑金属が溶解します.
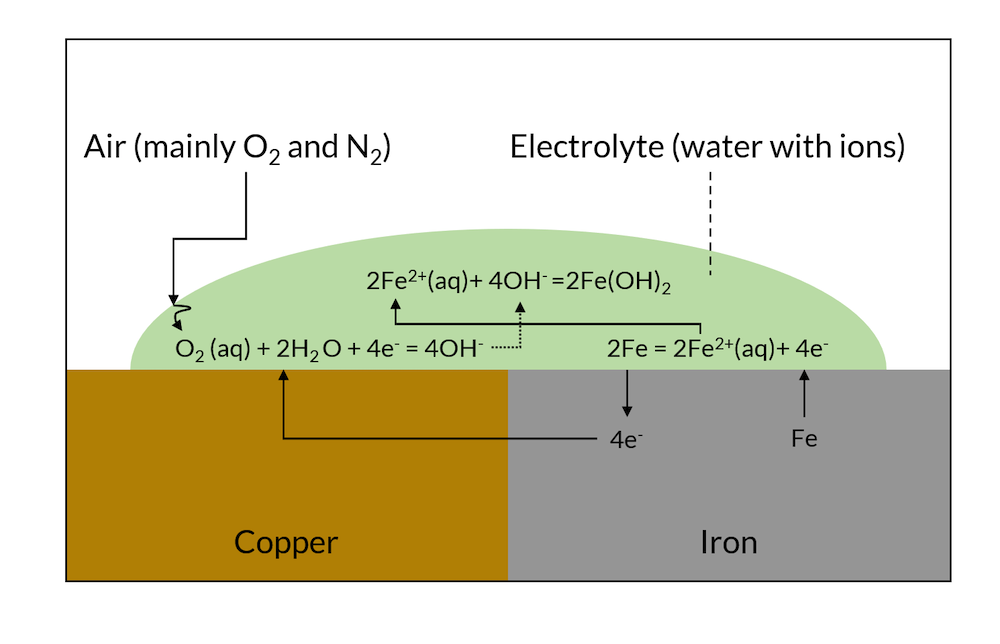
図1. ガルバニック腐食の模式図.
図1の反応をしばらく進行させると, 下の図2に示すように, 卑金属 (この場合は鉄) が貴金属との接触面近くで溶解することがあります.
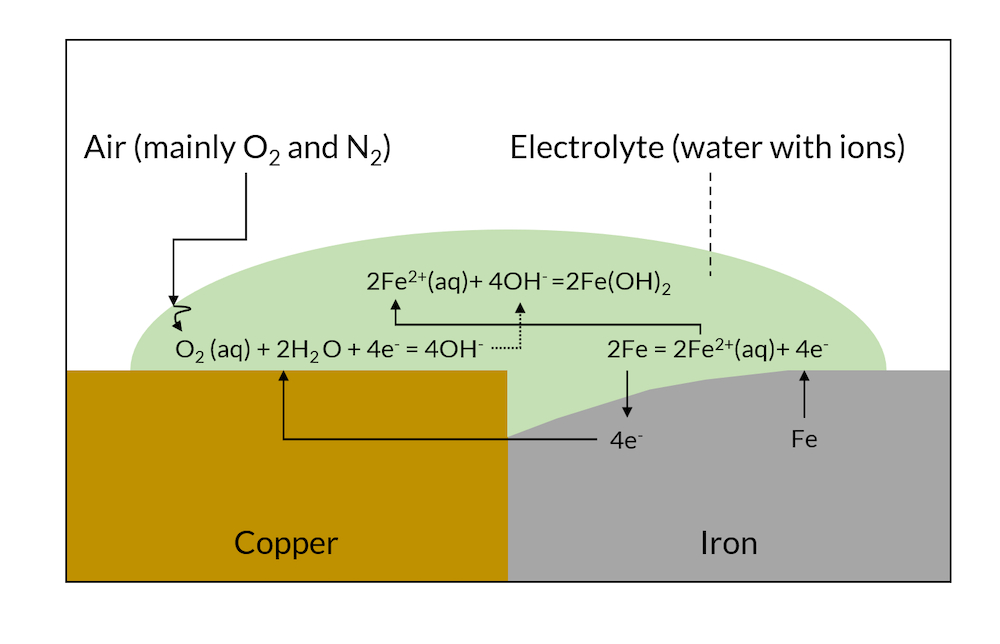
図2. しばらくすると, ガルバニック腐食により, 銅の接触部分に近い鉄金属の一部が溶解していることがあります.
ここで, 図3を参照し, 単一の金属の表面にある水滴を見てみましょう. 微視的構造には, 電子親和性がわずかに異なる金属相の領域がある場合があります. つまり, 例えば, 陰極反応が金属の結晶子で起こり, 陽極反応が粒界で起こるということです.
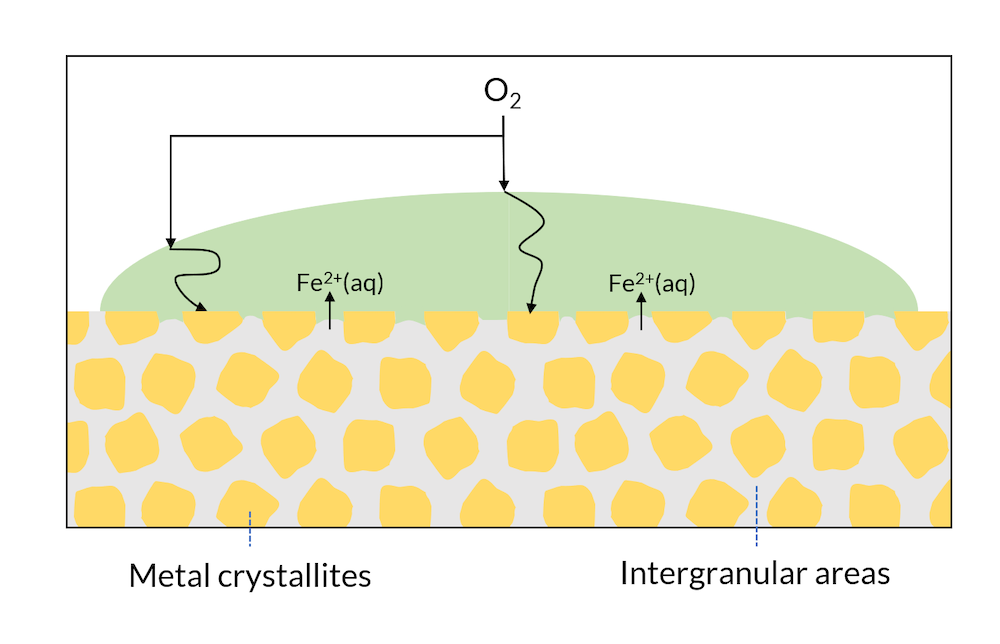
図3. 金属表面の領域は, 結晶と粒界で構成されることがあります.
図2で示されているように, 鉄が放出される表面の近くで水酸化鉄が形成されることがあります. これは錆の成分の一つです. 図3では, 粒界が非常に均一に分布しているため, 表面全体で錆が形成されます. これは通常, 全面腐食と呼ばれます.
図4を見てみましょう. ここでは図3のプロセスを進行させています. 結晶表面への酸素の輸送は, 酸素の拡散長が小さい液滴の端に比べて, 液滴の中央の方が長くなります. 液滴の中央の金属表面は酸素が欠乏しているため, この領域の電位は液滴端部の領域に比べて低くなります. これにより, 電位が鉄の不動態化電位より低くなり, 酸化鉄保護層が不安定化する可能性があります. 最終的には, 表面中央部の結晶が酸素欠乏により正味の陽極として機能します. これにより, 液滴の中央部で鉄が溶解し, ピットが初期化されます. 鉄イオンの生成見より水との反応も起こり, そこでプロトンが生成されるため, ピット内の pH が低下します. pH の低下により, 腐食速度はさらに加速されます. このプロセスは, 最初にこのプロセスを説明し再現した科学者にちなんで, エバンス落下実験 (参考文献1) と呼ばれています.
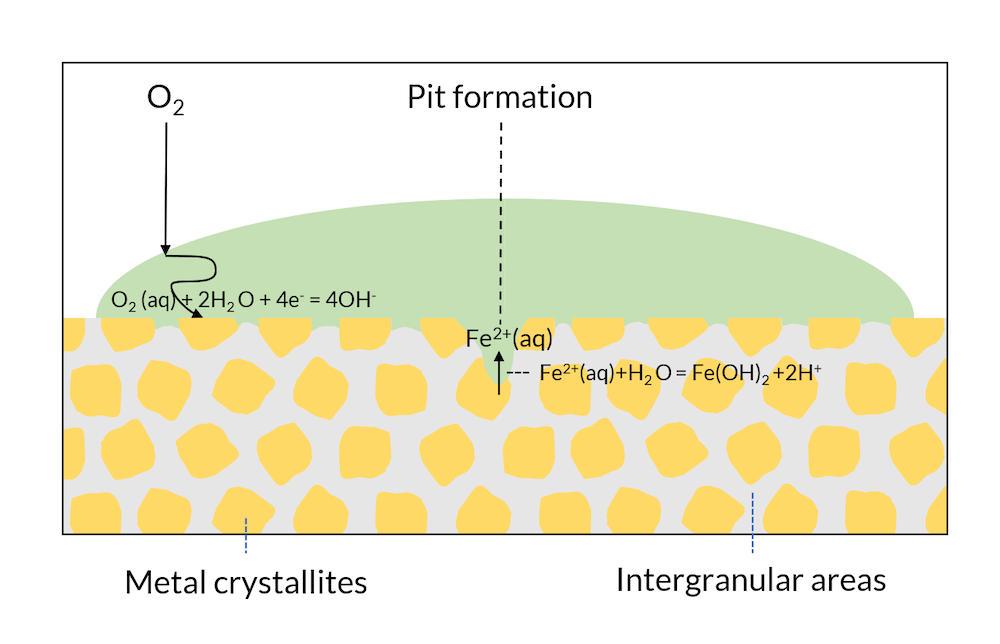
図4. エバンス滴下実験. ピットが形成されると, ピット内の pH も低下し, 陽極反応がさらに加速されます.
ピットの初期化は他のメカニズムで起こることもあります. たとえば, 機械的なくぼみや金属表面の不純物が, 鉄の表面をさらなる腐食から部分的に保護する酸化物を弱めることがあります. 特にステンレ ス鋼には, 機械的または化学的に損傷する可能性のある保護酸化物層があります.
孔食のモデリング
このブログのモデルは, ピットがすでに形成されている状態からスタートしています. また, モデル化された領域の外側に非常に大きな領域があると仮定しており, これによって局所電流の影響を大きく受けない安定した混合電位が与えられています. よって, ピットから離れた場所でも電解質電位が一定になります.
考慮される反応は以下のとおりです:
- 陽極分極した表面での鉄の溶解: \[2Fe = 2F{e^{2 + }}\left( {aq} \right) + 4{e^ – }\]
- 電解質中での沈澱反応: \[F{e^{2 + }}\left( {aq} \right) + 2O{H^ – } = Fe{\left( {OH} \right)_2}\left( s \right)\]
- 電解質中の水の自動プロトン分解: \[{H_2}O = {H^ + } + O{H^ – }\]
モデル化される化学種は以下の通りです:
- \[F{e^{2 + }}\]
- \[{H^ + }\]
- \[O{H^ – }\]
- \[N{a^ + }\]
- \[C{l^ – }\]
ヒドロキシルイオンの濃度は, 水の自動プロトン分解が平衡状態にあると仮定することで消去できます. 他のイオンの1つ (この場合はプロトン) は, 電気的中性条件を用いて消去できます. これらの消去は両方とも, COMSOL Multiphysics® ソフトウェアで, 水ベース, 電気的中立性ありオプションを選択することにより三次電流分布, ネルンスト・プランクインターフェースで自動的に処理されます. ただし, すべてのイオンの輸送方程式が, 電解質電流密度の式における電流のバランスに含まれていることにご注意ください. 最後の従属変数は電解質電位です.
初期状態については, 沈澱反応によってピット内部に推積物が形成され, 電解質が細孔を満たす多孔質構造とみなせると仮定します. 推積物は, ピットがあった場所にかつてあった金属から形成される可能性が高いので, これは妥当な仮定です. また, 図5で示されているように, モデルドメインは軸対称と仮定しています.
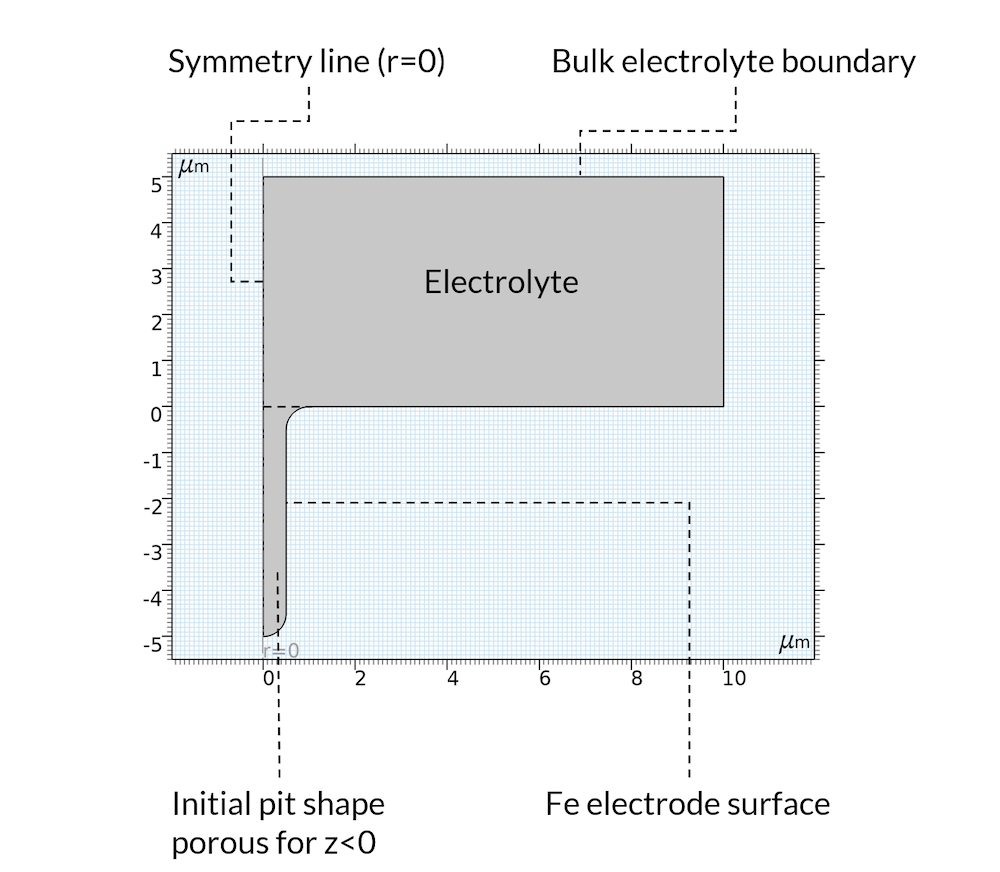
図5. モデルドメインのジオメトリと境界.
金属の溶解反応は, 上記図5において Fe 電極表面と示される境界の全域にわたって定義されます. 陽極反応速度はプロトン濃度に比例すると仮定します. これは, 塩化物が存在する酸性条件下で有効です (参考文献2). 鉄の溶解反応は, 移動メッシュを用いて境界の変位と連動します.
前述のように, 酸素還元反応はモデル化しません. 代わりに, ピットから遠く離れた水平位置に一定の電解質電位を設定し, これをバルク電解質境界と呼ぶことにします. この境界では, ナトリウム, 塩化物, 鉄イオン濃度も設定します.
ピットを含む電解質領域では, 水の自動プロトン分解と水酸化鉄反応の両方が起こると仮定します. 水酸化物が Fe(OH)2 (s) の生成を通じて消費されると, 図4で前述した pH の低下も促進されることに注目してください.
種の初期濃度と初期電解質電位は, プロセスが準定常状態にあると仮定して, 初期ジオメトリについて問題を求解することによって計算します. これは, 定常ソルバーを用いて, 上述の境界条件を使用して固定されたジオメトリに対して問題を解くことを意味します. その結果, t = 0 の時点ですでに一定の組成プロファイルと電解質の電位分布が得られます. この解が, 時間依存スタディの初期条件となります.
結果
電解質の組成と電位の変化は最初, 0~1日と比較的緩やかであるため, 初期の準定常状態は妥当な仮定であると思われます.
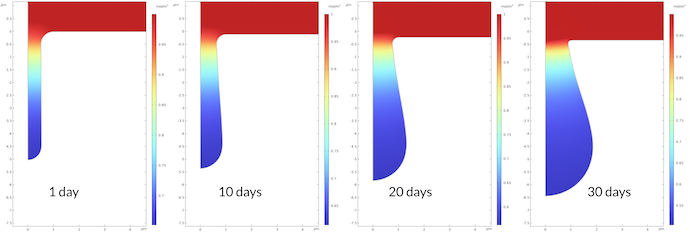
下の図6は, 30日間にわたるピットの成長を示しています. ピット内部では電解質電位の勾配が大きいです. 電解質電位は, ピット内では 0.43 mV から 16.5 mV の間で変化しているのに対し, 30日後のピット外では 0 mV から 0.43 mV の間で変化しています. ピット内では, ピット外の電解質に比べて輸送特性が低い多孔質媒体を想定しているため, 輸送が遅いことに注目してください. モデル化された全期間にわたって同じ定性的な電位分布が観察され, ピットの底の方がピットの口よりも速く成長することもわかります. その結果, ピットの口での電流の経路が相対的に狭くなり, 口での電解質電位の勾配が大きくなります. 平らな表面にも腐食が見られます. 30日間にわたり, 表面の変位は約 0.35 μm であるのに対し, ピットの底の同じ変位は 1.45 μm です.
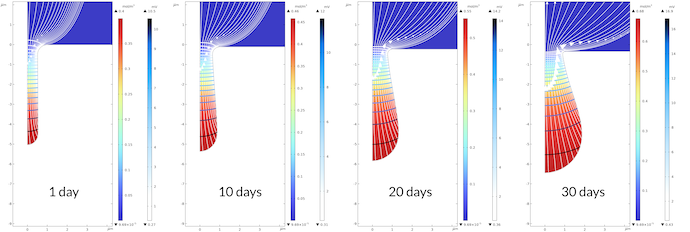
図6. ピットの底はピットの口よりも速く成長します. このため, 口に近いほど電解質電位の勾配が大きくなります.
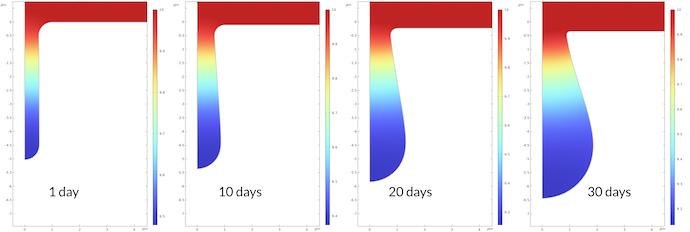
腐食過程における pH の変化を図7に示しています. 1日後のピット底の pH は 9.48 で, 30日後は 9.14 です. これは大きな変化ではないように見えますが, 1日後に比べて30日後のプロトン濃度が2.2倍高くなったことに相当します. 腐食過程の速度定数はプロトン濃度に比例するため, 腐食速度もそれに比例して加速されることになるのです.
図8は, 上記4つの時間での腐食速度 (μm/日) をプロットしたものです. ピット底部の最大腐食速度は, 1日後の腐食速度に比べ, 30日後は2.3高くなっています. これは, プロトン濃度が1日後に比べて30日後には2.2高くなることと一致しています.
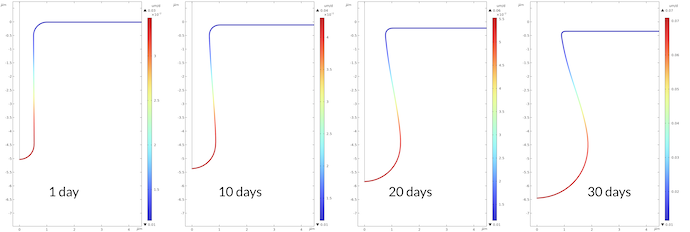
ナトリウムイオンの濃度プロファイルは, 鉄イオンのプロファイルと正反対になります. その理由は電気的中性の条件にあります. 鉄イオンが電解質に押し込まれると, ナトリウムイオンがピットから押し出されます. ナトリウムイオンとは逆に, 塩化物イオンは電気的中立性を保つためにピットに押し込まれるのです (図示せず).
このモデルは, 孔食の悪循環の側面を明確に示しています. ピットが十分に深くなり, 抵抗損失と腐食生成物が限界に達するまで, プロセスは時間とともに加速されます.
おわりに
このモデルを拡張する方法として, 沈澱した腐食生成物の物質バランスを考慮することができます. これらの生成物は鉄金属よりも密度が低いため, ピット内で形成されますが, ピットの外側にも押し出されます. これは, 空隙率を従属変数として導入し, 酸化物の移流によって輸送を与えることによってモデル化できます.
また, モデルを自然に拡張するもう一つの方法として, 酸素拡散と酸素還元を含めるために, 完全な液滴ジオメトリを考慮することができます.
さらに, 三つ目の方法としては, より詳細な化学を含めることができます. 例えば, より多くの鉄イオン, より多くの酸化還元反応, さらに金属表面の鉄酸化物や水酸化物を含めることなどできます. その一方, 比較的単純なモデリング手順にもかかわらず, かなり高度な既存のモデルで遊んでみることもできます.
次のステップ
- 腐食モジュールの特徴や機能の詳細については, こちらをご覧ください.
- この関連チュートリアルモデルをダウンロードして, 孔食のモデリングをご自身でお試しください.
参考文献
- U.R. Evans, “Corrosion and Oxidation of Metals”, Amolds, p. 118., 1960.
- H.C. Kuo and K. Nobe, “Electrodissolution Kinetics of Iron in Chloride Solutions”, J. of Electrochem. Soc, vol. 125, no.6, 1978.






コメント (0)