
以前のブログでは, 高速検出テストの運用の背後にある原則を免疫クロマトグラフィー (LFA) に基づいて紹介しました. この投稿では, COVID-19 検出のためにそのようなテストがどのように見えるかを見ていきます. さらに, これらのシンプルで堅牢でありながら非常に高度なマイクロラボを理解するために使用できる3つのモデルを紹介します.
COVID-19 テストの仕組み
体がコロナウイルス SARS-CoV-2 に感染すると, 免疫系は抗体を形成することによって迅速に反応します. 樹状細胞は, T 細胞による認識を可能にするウイルス抗原を提示する可能性があります. T 細胞は B 細胞を活性化して, 抗原を標的とする抗体を分泌する可能性があります (参照1). 最初に形成されたものの中には, いわゆる IgM 抗体があります. これらの抗体は, ウイルス粒子が近づくとすぐにウイルス粒子上のいわゆる抗原の表面に付着します. コロナウイルスの場合, 抗原はウイルスの表面にあるスパイクタンパク質 (S 抗原) である可能性があります. 抗原に付着すると, 抗体はウイルスのスパイクタンパク質をブロックし, ヒト細胞への付着と感染を妨げます. 感染した細胞の外で複製することができないので, これはウイルスを中和します. さまざまな抗原を標的とする可能性のあるさまざまな抗体がいくつかあります. 感染と戦うための他のメカニズムもあることに注意してください. さらに, ウイルスを認識する T 細胞は, 感染した細胞を直接標的にすることもあります. 彼らは細胞に自己破壊するように指示することができます. あるいは彼らは感染した細胞を殺すかもしれません. それでウイルスを中和することもできます.
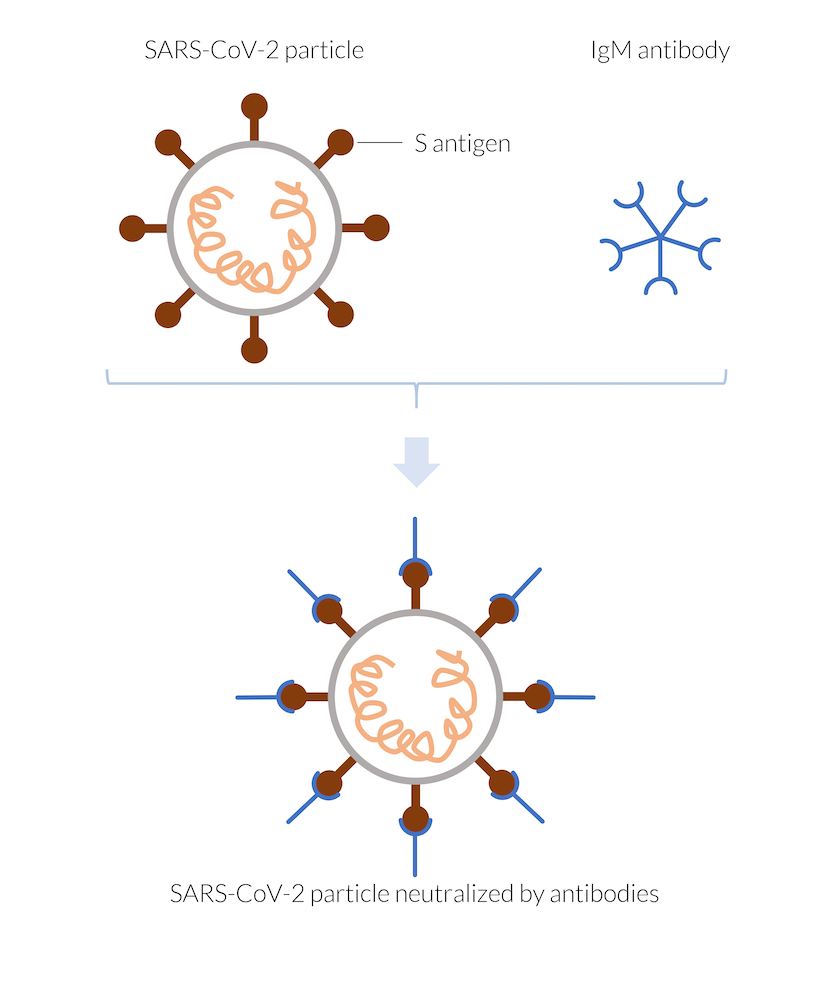
免疫系によって作製された IgM 抗体は, 例えば, SARS-CoV-2 ウイルス粒子のスパイク抗原 (S 抗原) に付着し, 粒子を中和します. 中和されたウイルスはヒトの細胞に侵入できないため複製することはできません. ウイルス粒子は破壊されます.
IgM 抗体は, 5つのグループで体をパトロールし, 小さな粒子 (または大きな分子) を形成し, 遭遇するすべてのウイルス粒子に付着します. 感染の後半では, 免疫系は他の抗体, たとえば IgG も形成します. これらの抗体は自分で体をパトロールし, 目にするすべてのウイルス粒子に固定します. IgG 抗体は, 体内での製造に時間がかかりますが, 存在する限り長持ちし, 免疫を付与します.
COVID-19 の LFA 高速検出テストのいくつかは, IgM 抗体と IgG 抗体の両方の検出に基づいています. これらは, このブログで取り上げられているモデルで調査されているテストです.
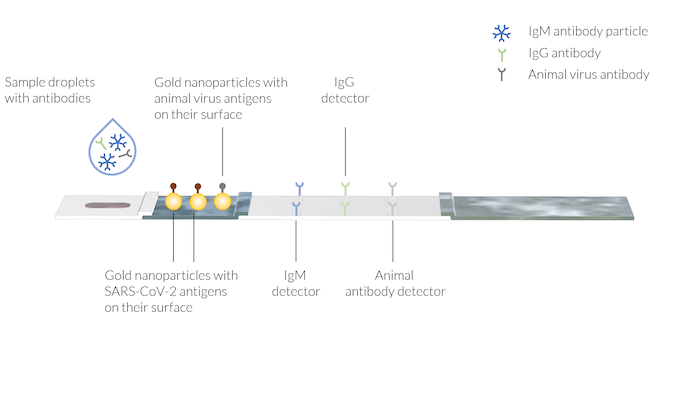
サンプルには, COVID-19 感染により作成されたヒト抗体 IgM および IgG が含まれています. 動物抗体も緩衝液とともにサンプル液に添加されます. テストラインには, 3つの異なる領域に固定化された抗体検出器があります. テストラインはまだ表示されていないことに注意してください.
患者の血液 (または唾液) をサンプルウェルに塗布した後, サンプルウェルに数滴の緩衝液を滴下して緩衝液を塗布します.
サンプルは毛細管力によって共役パッドに輸送されます. ここで, IgM および IgG 抗体は共役ラベルに付着します. 共役ラベルは, 表面に SARS-CoV-2 抗原を有する金ナノ粒子であり得る. 次に, 2つの異なる複合体が形成されます:
- 共役 (IgM-C) と IgM
- 共役 (IgG-C) と IgG
これらの複合体がサンプル液体に溶解します.
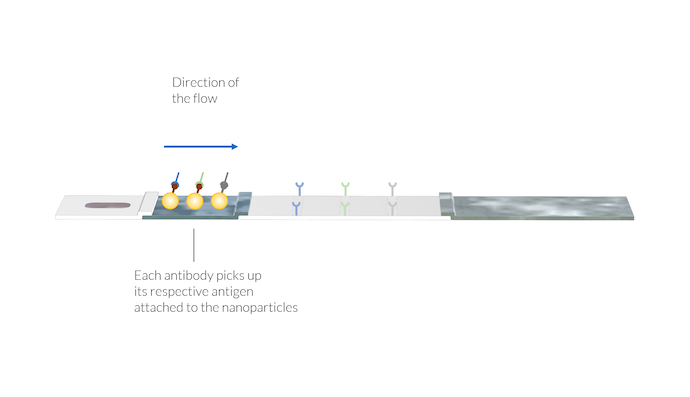
IgM および IgG 抗体は, 粒子表面の SARS-CoV-2 抗原に付着することにより, 金粒子を検出します. また, 動物ウイルス抗体はそれぞれの粒子を吸着します. 抗体と粒子の複合体は流れに溶解し, サンプル溶液とともにメンブレインに運ばれます. テストラインはまだ表示されていないことに再度注意してください.
さらに, 金ナノ粒子に付着した動物ウイルス由来の抗原との2番目の共役体が存在する可能性があります. これらの共役レベルは, 緩衝液によって提供される参照動物抗体に付着する可能性があります. 動物抗体と共役ラベル (AA-C) の複合体もサンプル液に溶解し, 後で参照ラインで検出するために使用されます.
次に, サンプルは毛細管力によってメンブレインに輸送されます. 最初のテストラインでは, IgM 検出器はメンブレインの製造中にメンブレインの表面に固定化されます. これらの IgM 検出器は, IgM-C 複合体を捕捉し, このテストラインの領域でこれらの複合体を静止状態に保ちます. ナノ粒子は蓄積し, テストラインを赤く着色することでテストライン上の複合体の存在を明らかにします.
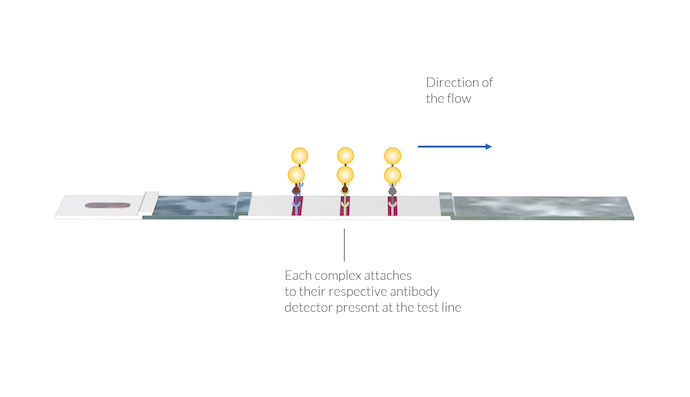
抗体-抗原-金ナノ粒子複合体は, テストラインの位置にあるそれぞれの抗体検出器に付着します. 複合体がテストラインの表面に固定化されると, 表面に金のナノ粒子が存在するため, テストラインの色が表示されます.
同様に, IgG-C 複合体は2番目のテストラインで固定化された IgG 検出器と反応します. IgG-C 複合体が IgG 検出器に付着すると, 金ナノ粒子の存在により, 2番目のテストラインの色が赤に変わります.
次に, コントロールテストラインは, AA-C 複合体に遭遇したときに, コントロールテストライン領域のメンブレインに取り付けられた動物抗体検出器を使用することにより, 同様の方法で反応します. コントロールテストラインの色は, サンプルが IgM および IgG 検出領域を含むメンブレイン領域を通過したことを示しています. コントロールテストラインが着色されていない場合, サンプルが十分な方法でメンブレンを通過していないため, テストを破棄する必要があります.
流れは吸収パッド (芯パッド) に続きます. このパッドの細孔容積は, テストストリップを流れることができるサンプル容積を決定します. 吸収経路が一杯になると, テストストリップ内の流れが停止します. 流れを再開する唯一の可能性は, 吸収パッド内のサンプル液体の一部を蒸発させることです.
COMSOL Multiphysics® における3つの高速検出テストモデル
3つのモデルを使用して, LFA 高速検出テストを調査します.
まず, 完全な 3D モデルを使用してサンプル液がテストストリップ内に均一に分布しているかどうかを確認し, サンプルウェルの位置の影響を調査します. また, テストストリップを通る流れを提供するための吸収パッドの吸収能力は, 3D モデルで調査することができます.
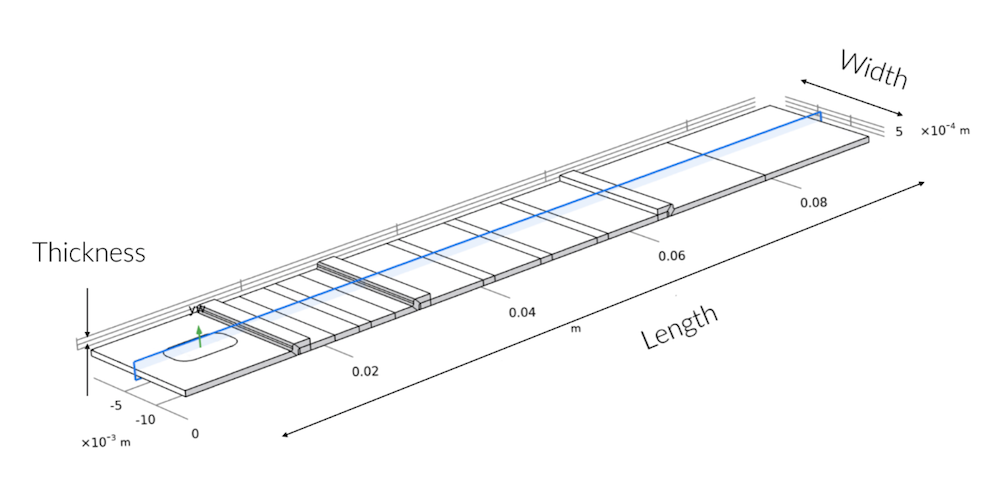
青い網掛けの断面は, 3D ジオメトリの 2D モデリング平面を示しています. 幅に沿った対称性からの逸脱は, サンプルウェルがテストストリップの全幅を超えていないサンプルパッドでのみ見られます.
サンプルパッドを通過すると, サンプルの流体の流れがすぐに平坦な速度プロファイルを形成することがすぐに明らかになりました. これは, テストストリップの幅に沿って均一に流れることを意味します. これは, サンプルパッドが流れを均一に分散させる役割を果たしている限り, 2D モデルで高速検出テストデバイスの課題と機能を理解するのに十分であることを意味します. したがって, 2D モデルを使用してテストストリップ内の輸送と反応を調査しました. 2D モデルを使用すると, テストストリップの長さと厚さの両方に沿ってメッシュのより高い解像度を使用できます.
モデルは多孔質媒体の流れのためのリチャーズの式インターフェースと COMSOL Multiphysics の希釈種輸送インターフェースを組み合わせています (参照2). IgM-C, IgG-C, および AA-C 複合種を形成する反応は化学インターフェースによって定義されます. また, テストラインでの表面反応は化学インターフェースによって定義されます. 2D モデルでは, 2つの異なるアプローチを使用しました:
- テストラインでの複合体の吸着は表面でのみ起こると仮定
- 検出における吸着プロセスは, テストラインの位置より下のメンブレインの全厚に沿って行われると仮定
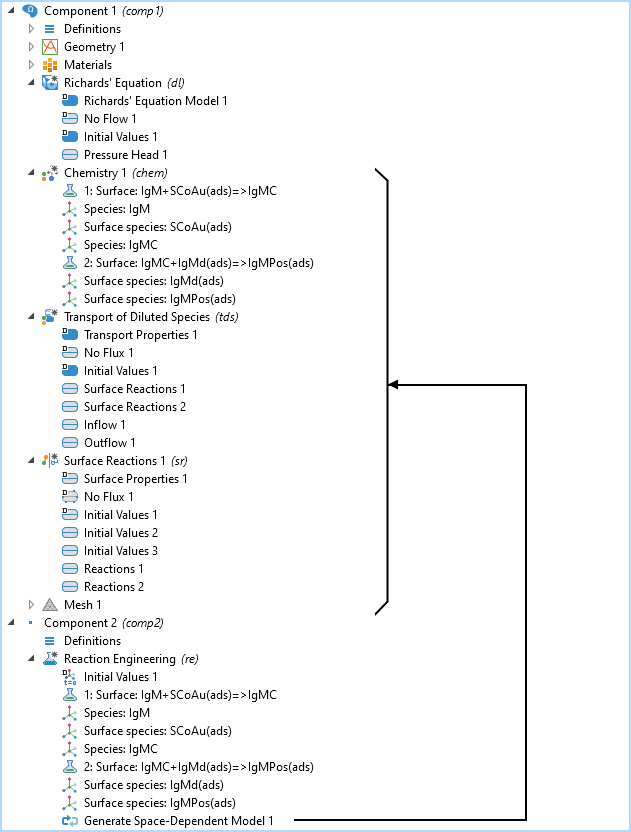
リチャードの方程式モデル, 化学, 希釈種輸送, および表面反応インターフェースを備えた 2D モデルコンポーネントを含むモデルツリー反応工学インターフェースを備えた 0D モデルコンポーネントも同様です. 空間依存モデルの生成ノードは, リチャード方程式インターフェースを使用して, 既存の 2D モデルコンポーネントに輸送および化学インターフェースを追加します.
IgM 反応経路のモデルツリー. 化学, 希釈種輸送, および表面反応インターフェースはすべて 反応工学インターフェースによって作成されます. 化学反応は空間依存モデルの生成機能を使用して定義されます.
共役パッド内の化学反応は次のように定義されます:
- 結合パッド内の金ナノ粒子上の IgM と SARSCo-2 抗原の間の反応は次のように定義されます: IgM +SCoAu(ads) => IgMC
- (ads) という用語は, 抗原とナノ粒子が共役パッドの細孔構造に吸着され, IgM によって吸着されて, 溶液に溶解する複合体 IgMC を形成することを示すために使用されます.
- IgG 抗体と同様の反応が得られます: IgG + SCoAu(ads) => IgGC
- 動物抗体 (AA) と金ナノ粒子 (AAu) 上の動物抗原との反応は次のように定義できます: AA + AAu(ads) => AAC
したがって, IgMC, IgC, および AAC は抗体-共役複合体です.
テストラインにおける反応は以下の通りです:
- 最初のテストライン: IgMC + IgMd(ads) => IgMPos(ads)
- IgMC 複合体が吸着された IgMd 検出タンパク質と反応して吸着された IgMPos 表面種を形成することを示しています. 固定化された IgMPos の形成により, 最初のテストラインに検出色が与えられます.
- 4と同様に, 2番目のテストライン: IgGC + IgGd(ads) => IgGPos(ads)
- 吸着種 IgPos は2番目のテストラインに赤色を与えます.
- 3番目のテストライン: AAC + AAd(ads) => AAPos(ads)
- 吸着種 AAPos はコントロールテストラインに赤色を与えます.
モデルの結果
次の図は, 4つの異なる時点でのテストストリップのフロープロファイルを示しています. 最初に, サンプルの前面がテストストリップの中央に沿ってテストストリップにさらに達し, わずかに放物線状のプロファイルを形成していることがわかります. 放物線状のプロファイルは, テストストリップの中央にあるサンプルウェルの位置によるものです. ただし, 5秒後, 流れがすでに共役パッドに約3分の1に達した場合, フロープロファイルは平たんになります (前のブログの最後の図を参照).
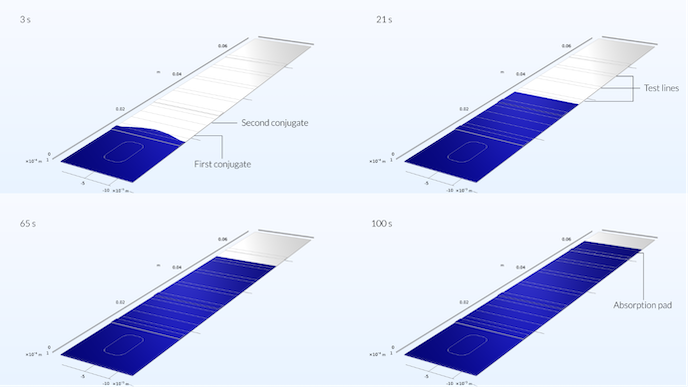
サンプルは3秒後にすでに最初の共役領域に到達しています. ここでは, サンプルの位置がサンプルの広がりに与える影響を確認できます. これは, サンプルが平坦ではなく, 中央で最大の到達を示しているためです. 21秒後, サンプルが最初のテストライン領域に到達するまでに, 速度プロファイルは直線になります. 65秒後, 流れは参照テストラインに到達し, 100秒後に吸収パッドに到達しました.
このプロットでは, チャネルの中央にあるテストストリップに垂直な平面に沿って解が対称であることがわかります. これは, デバイスの半分だけで問題を求解できたことを意味します. 問題が対称的であるにもかかわらず, デバイス全体をモデル化することにより, メッシュが流れプロファイルについての結論を出すのに十分な密度であることが確認できます. 流れプロファイルが対称であるという事実は, メッシュがここで十分に密である可能性があることを示しています.
また, 最初のテストラインの位置でのサンプルの流速プロットを見てみましょう. 下の図を参照してください. サンプルをサンプルウェルに塗布してから約20秒後に流れが開始することがわかります. 流れは約275秒で停止します. これは吸収パッドが液体サンプルでいっぱいになる時間と一致します.
また興味深いのは, 流量が時間とともに減少し, ほぼ指数関数的に減衰することです. これは, 流れを駆動する毛細管力が, サンプル液体が空気と出会う細孔表面 (液体前面の三相境界領域) にのみ作用するという事実によるものです. これは, サンプル液体で満たすための自由細孔容積がある限り, この力が一定であることを意味します. ただし, サンプル液体がテストストリップにさらに到達すると, 流れに対する抵抗が増加します. 流れるサンプル液体と接触する細孔壁の面積は時間とともに増加し, したがって細孔壁と流れる液体との間の摩擦面積も増加します.
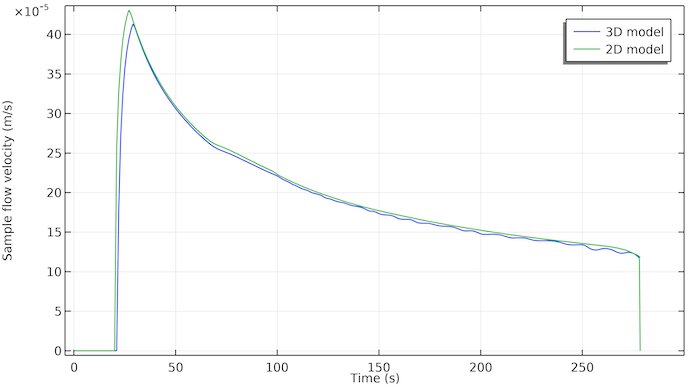
3D モデル (青) と 2D モデル (緑) の最初のテストラインの位置でのサンプル流速. 2つの曲線はまともな一致です. 3D モデルは, 約2秒の遅延を示しています. これは, サンプルが最初に幅に沿って流れる必要があるためと考えられます. 2D モデルでは, サンプルは幅に沿って瞬時に均等に広がります.
IgMC 複合体の濃度がさまざまな時間ステップで下の図に示されています. IgMC は, 最初のテストラインの領域に到達するまで, 流体の流れとともに移動することがわかります. ここでは, IgM 検出種との反応によって消費され, 色付きの検出ラインを形成します. IgMC 濃度場は, テストラインに到達した後, 濃度境界層が形成されることを示しています. テストライン後の濃度低下プルームは時間とともに発生し続けますが, テストライン周辺はほぼ定常状態になります. ただし, 流れが停止すると, 吸収パッドがサンプルで飽和し, テストラインの下に厚い空乏領域が形成され, メンブレイン全体に到達します. 同様に, 共役線の下の領域は IgMC 種によって飽和されます.
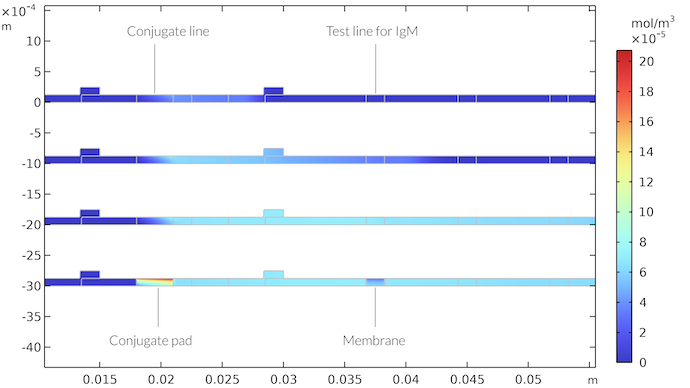
結合パッドおよびメンブレインにおける時間の関数としての IgMC の濃度場. 時間は21秒後 (上), 65秒後, 260秒後, および410秒後 (下) です. 410秒後, テストストリップを通る流れはなくなります. 共役パッド内の IgMC 濃度が高いゾーンと, IgM のテストラインより下の IgMC 濃度が低いゾーンが得られます.
テストラインの表面で検出種の粒子濃度をプロットすると, 流れの影響は明らかです. 粒子濃度の増加は, 流れがそれぞれのテストラインに到達したときに与えられる遅延から始まります. IgMC がテストライン領域に吸着され, 検出器種 IgMPos が形成されると, 濃度はほぼ直線的に増加します. 直線的な増加は, 一定の吸着速度を意味します, 吸収パッドが飽和しているために流れが止まると, IgMPos の形成速度はほぼ同じ速度で継続します. これは, この場合, IgMPos の形成が吸着速度論によって決定されること, つまり, IgMC 内の金ナノ粒子の吸着サイトへの吸着速度によって決定されることを意味します. 物質移動制御の場合, 曲線の傾きが変化し, 流れが止まると成長が遅くなります. もちろん, 吸着速度の速度定数を変更すると, これも変わる可能性があります. テストラインの可視性は, 約1·108粒子/mm2から始まります.
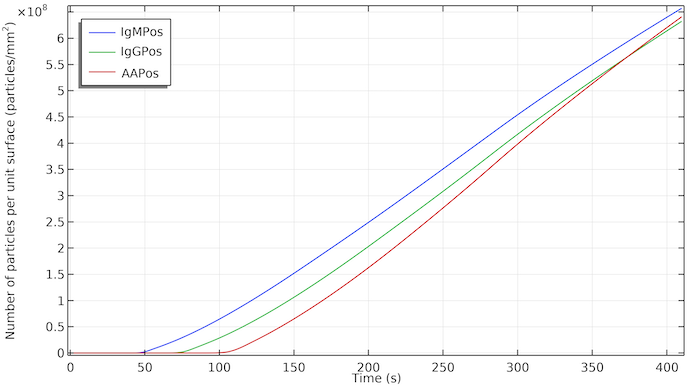
時間の関数としての, それぞれのテストライン表面での IgMPos, IgGPos, および AAPos の濃度. IgMPos と IgGPos は同じ共役ラベルをめぐって競合するため, AAPos はわずかに速く成長します.
したがって, 3つのテストラインの反応速度が類似している場合, 1番目, 2番目, および3番目 (コントロール) のテストラインが現れることがこの順序で遅れることになります. さらに, 各テストラインは, 流れに面するエッジで色付けされ始め, テストラインの後続部分が少し遅れて表示されます.
同種の場合の反応速度を調整すると同種モデルは同様の結果を示します. ただし, ここでは, 反応サイトが共役パッドの厚さ全体に広がり, テストラインの場合はメンブレインの厚さ全体に広がるため, 輸送ははるかに高速です. 反応物をテストストリップの表面に輸送する必要はありません. これにより, 速度論と物質移動の両方がテストラインが現れるのを制限する, より混合されたプロセスが得られます. 下の図は, 上記の不均一なケースに対応する IgMC 濃度を示しています.
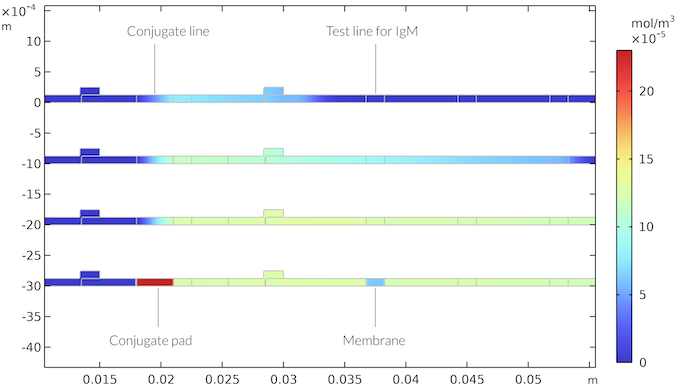
共役領域に共役ラベルが厚さ全体に含まれ, テストラインがメンブレインの厚さ全体に存在する場合の IgMC 濃度. 結果は異種の場合と同様です.
以下のプロットは, テストラインが現れる様子を示しています. 流れの方向に少し傾くと, ほぼ均一に現れ始めることがわかります. 流れが止まると, テストラインの両端で彩度が高くなります. これは, これらのエッジへの拡散による抗体コンジュゲート複合体の輸送が多いためです.
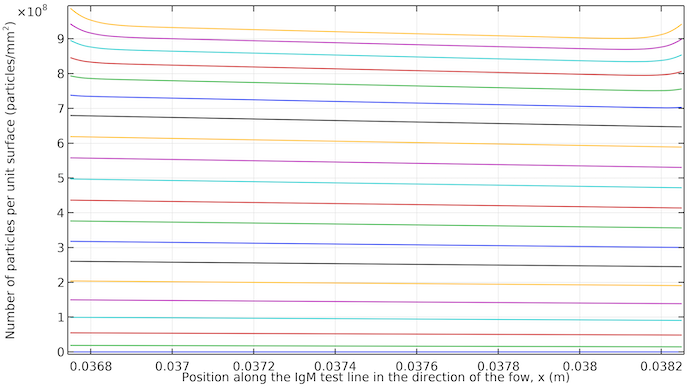
IgM テストラインで10 μm の厚さにわたって統合された単位表面積あたりの IgMPos の濃度. プロットは20秒から400秒で, 20秒刻みです. 曲線は, 下部 (低彩度) で20秒で始まり, 上部 (高飽和) で400秒で終了します. 約260秒後, 拡散が抗体複合体標識複合体をテストライン領域に輸送する唯一の方法であり, プロセスが遅くなるため, 時間ステップ間で曲線が近くなります.
現実は, 同種モデルと異種モデルの中間にある可能性があります. 幅全体に均一に着色されたテストラインを取得するための良いアプローチは, テストストリップの表面に近い検出ボリュームを持つことであると考えることができます. このようにして, 輸送は x および y 方向から発生する可能性があり, 同時に比較的大きな反応ゾーンが得られます (下の図を参照) . メンブレインは透明ではないため, テストラインの場合, 反応ゾーンをメンブレインの厚さ全体に広げることもテストの可視性に寄与しません. しかしながら, 共役パッドの反応ゾーンが厚さ全体に分布している場合, これは共役ラベルと抗体との間の反応を最大化するので, それは利点です. このようにして, 共役ラベルは可能な限り多くの抗体を吸着します.
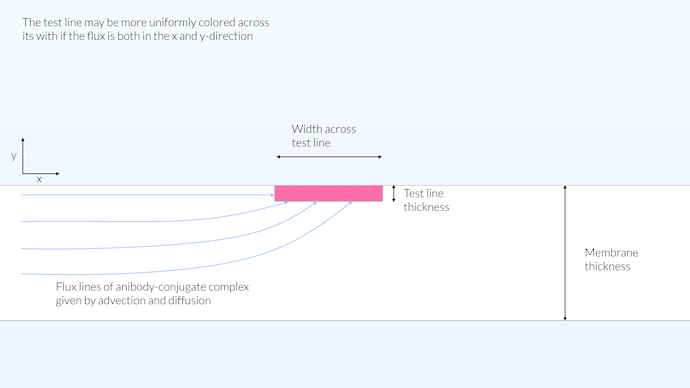
この構成では, テストラインの反応ゾーンは表面に限定されず, メンブレインの厚さ全体にも分布せず, 15 μm の厚さに制限されます. メンブレインは透明ではなく不透明で, 視認性の深さは約10 μm です. 限られたテストラインの厚さは, テストラインの幅全体にわたる輸送を可能にし, したがって, メンブレインの幅全体にわたって比較的均一な彩度をもたらします.
おわりに
テストストリップ上のサンプル流れの間隔は, 吸収パッドのサイズによって決定されます. 吸収パッドはサンプルのサイズも決定します. もちろんこれは明らかであり, LFA デバイスを扱う科学者やエンジニアにとって新しいことは何もありません. さらに興味深いのは, サンプルがテストストリップ上を進むにつれて, モデルが流量の指数関数的減衰を予測することです. これはこの分野の科学者にもよく知られていますが, 完全には明らかではない可能性があります.
2D シミュレーションは, 異種の場合のテストストリップ内の物質移動が遅いように見えることを示していますが, 吸着速度はとにかく律速段階であるように見えます. 流れはサンプルをテストストリップ全体にすばやく分散させるようです. ただし, 吸着反応は非常に遅いため, 異種の場合のテストラインでの検出種の形成は制限されます. 同種の場合, 反応サイトへの輸送は直接流れの方向にあり, 少なくともサンプルの流れがある限り, 拡散に依存する必要がないため, 反応速度はさらに制限されます. ただし, これらの結果はもちろん, 使用した入力データに関連しています.
このブログ用に作成されたモデルは, 化学の観点から概略的です. それらをテストストリップの実際の開発に使用するには, 化学および多孔質材料の特性の入力データの生成にさらに大きな努力を払う必要があります. ただし, モデルには重要な現象が含まれています. 比較的詳細な輸送と反応の説明です.
考えらえるモデルの改善
- メンブレインに沿ったあらゆる場所での吸着と脱着の説明: ここでは, すべての化学種がテストラインで恒久的に吸着されるまで自由に輸送されると仮定しています.
- より正確な二層流モデル. 多孔質媒体には, 単純な2相流モデルを使用しました. フェーズフィールドに基づくより正確なモデルも使用できます.
- 科学文献に発表された特定のテストからの入力データ: テストストリップアセンブリのすべてのパッドに同じ気孔率と濡れ特性を使用しました. 濃度と吸着速度は, 妥当な結果を生成する入力データを使用します. ただし, 濃度と反応速度の現実的なデータを使用するには, 文献検索を行う必要があります. ただし, これは COVID-19 検査ごとに異なり, メーカーごとに独自のサンプル準備と検出手順があります. このブログの目的は, 科学論文を公開することではなく, 可能なモデリングアプローチを提示することです.
- メッシュ収束解析. これはシミュレーション結果で期待できる精度を示しています. これは部分的に行われ, モデルの数値誤差は比較的小さいことがわかっています. しかし, これを厳密に行うことはこのブログの範囲外です.
参考文献
- L. Gutierrez, J. Beckford, and H. Alachkar, “Deciphering the TCR Repertoire to Solve the COVID-19 Mystery”, Trends in Pharmacological Sciences, vol. 41, no. 8, pp. 518–530, 2020, (https://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(20)30130-9),
- D. Rath and B. Toley, “Modelling-Guided Design of Paper Microfluidic Networks – A Case Study of Sequential Fluid Delivery”, ChemRxiv, 2020, https://doi.org/10.26434/chemrxiv.12696545.v1.
モデルをダウンロード
COVID-19 の高速検出テストのモデリングを試す準備はできましたか? 下のボタンをクリックしてモデルファイルにアクセスしましょう:



コメント (0)